Hoje é 08 de Fevereiro de 2014. Há exatos 180 anos nascia o "Pai" da Tabela Periódica...Dimitri Ivanovich Mendeleiev.
 |
| Mendeleiev em seu gabinete |
Dimitri nasceu em Tobolsk, oeste da Sibéria, e era o caçula de 14 ou 17 irmãos (ninguém sabe ao certo) e pelo esforço de sua mãe, em 1847, Maria Dmitrievna, ,que após a morte de seu pai e o incêndio que destruiu a fábrica de vidros da família partiu para Moscow levando o pequeno Dmitri, com 15 anos e sua irmã, Liza.
Não tendo sucesso de matricular Dmitri em uma universidade de Moscow, a família se deslocou para a capital São Petersburgo, onde no Instituto Pedagógico Central conseguiu uma pequena bolsa do governo para estudar matemática e ciência natural.
"Abstenha-se de ilusões, insista no trabalho e não em palavras. Busque pacientemente a verdade divina e científica" foi os dizeres de sua mãe, em seu leito de morte.
Apesar de todas as dificuldades, mesmo sendo diagnosticado com uma tuberculose, onde lhe foi dado apenas alguns meses de vida, em 1855 Mendeleiev formou-se com professor secundário, ganhando ainda a medalha de ouro de melhor aluno.
Passando de docente em Simferopol, na Criméria, onde conheceu o renomado cirurgião Perogov que após um check-up diagnosticou sua doença como não fatal, Mendeleiev retornou a São Petersburgo onde aos 22 anos de idade foi designado como privat Dozent, uma espécie de professor que não é contratado nem remunerado, dependendo da contribuição pagas pelos alunos que frequentava seu curso.
Sentindo que ali, não poderia prosperar, em 1859 Mendeleiev conseguiu verba do governo para estudar no exterior. Seu primeiro destino foi Paris onde estudou sob os olhares de Henri Regnaut, o mais consagrado experimentalista da época e o primeiro a estabelecer que o zero absoluto era - 273 graus Celcius.
Após passar uma temporada em Paris, Mendeleiev deslocou-se para Heidelberg, Alemanha. Ali assistiu aulas de Gustav Kirchhoff e trabalhou com o grande parceiro dele, Robert Bunsen (inventor do bico de Bunsen, ainda encontrado em qualquer laboratório de química). Por trabalhar com Bunsen, Mendeleiev viu-se no lugar certo tendo acesso privilegiado com os últimos desenvolvimentos no campo dos elementos químicos e sobre os estudos para estabelecer um padrão para as massas atômicas dos elementos químicos.
Em 1861 Mendeleiev retorna a São Petersburgo assumindo o cargo de professor assistente no Instituto Técnico chegando até a escrever uma obra de química orgânica de 500 páginas por não haver um manual russo de química orgânica e posteriormente tornando-se professor titular em 1864.
Aos 32 anos, casado e pais de um casal de filhos, foi nomeado professor de Química Geral na Universidade de São Petersburgo, cargo bastante prestigioso para um jovem e grande conhecedor pelo seu conhecimento enciclopédico dos elementos químicos.
Além do cargo de professor, Mendeleiev dava consultorias para os produtores de queijo da Cooperativa Econômica Voluntária de Tver. Em suas longas viagens de trem, Mendeleiev costumava passar o tempo jogando paciência sob seu baú de madeira apoiado em seus joelhos. Essa organização das cartas do baralho em ordem descendente despertou-o.
Diz a lenda, que em uma manhã, Mendeleiev, em seu gabinete, escreveu nas superfícies de cartões brancos de papel o símbolo dos 63 elementos químicos conhecidos, bem como suas massas atômicas e algumas propriedades características dispondo-os em grupos.
Após inúmeras tentativas e exausto deste afazer e percebendo que certas propriedades similares repetindo-se em intervalos regulares, Mendeleiev debrucou-se sobre a mesa, repousando a cabeça em seus braços, adormeceu...e teve um sonho!
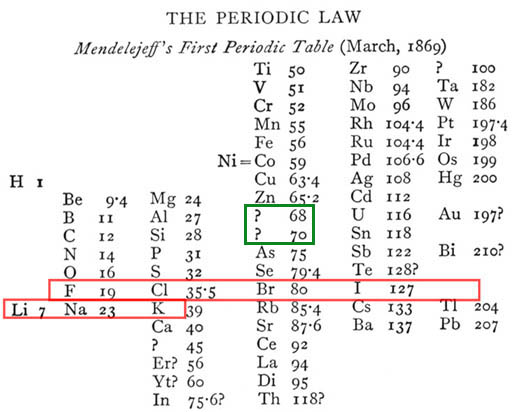 |
Agrupamento dos elementos conhecidos por Mendeleiev. Note
os elementos de número de massa 68 e 70 previstos
pelo químico, que posteriormente foram descobertos como Gálio
e Germânio. |
Em suas palavras "Vi num sonho uma tabela em que todos os elementos se encaixavam como requerido. Ao despertar, escrevi-a imediatamente numa folha de papel." Ele compreendeu que os elementos eram organizados na ordem de suas massas atômicas, suas propriedades se repetiam em uma série de intervalos periódicos no qual chamou sua descoberta de Tabela Periódica dos Elementos.
Sua genialidade não se limitou somente em organizar os elementos. Ele fez previsões de propriedades físicas e químicas de elementos ainda não descobertos na época, como o Gálio e o Germânio.
Essa genialidade também foi posto a prova em uma das maiores paixão russa: A Vodka. Esta bebida que em russo significa "aguinha", e foi criada em 1893, foi aperfeiçoada por Mendeleev. Após um ano de estudo, chegou-se a fórmula perfeita desta paixão russa que apresenta 40% de álcool (etanol) e 60% de água a qual foi registrada por lei a fórmula proposta pelo químico russo.
Mendeleiev morreu em 2 de Fevereiro de 1907, mas o que ele descobriu em 17 de fevereiro de 1869 viverá para sempre. Em 1955 o elemento químico 101 foi descoberto, tomando seu lugar na tabela periódica e levando o nome de Mendelévio (Md), sendo este um elemento instável, sujeito a fissão espontânea, exatamente como temperamento do gênio citado neste texto.
Essa história pode ter sido só uma lenda, mas de qualquer maneira, não deixa de ser fascinante!!
Fonte: O sonho de Mendeleiev, de Paul Strathern